一. 新加坡医疗器械市场分析
新加坡预计2024年的医疗器械市场收入将达到10.84亿美元,其中心脏病学设备是新加坡医疗器械市场中规模zui大的类别,2024年规模约为1.564亿美元。预计2024至2029年将以9.16%的复合年均增长率增长,到2029年市场规模将达到16.8亿美元。新加坡凭借其医疗创新技术和强大的监管框架在医疗器械市场中处于领xian的地位。
二. 新加坡医疗器械监管机构及法规要求
监管机构:新加坡医疗器械注册是由Health Sciences Authority(HSA)卫生科学局的医疗器械监管部门负责监管。
法规要求:
1. the Health Products Act 2007,《2007 年健康产品法》
2. Health Products (Medical Devices) Regulations 2010,《2010 年健康产品(医疗器械)条例》
三. 新加坡医疗器械定义及分类
定义:医疗器械是指直接或间接用于人体时产生物理或机械效应的健康产品。这些器械的使用旨在达到以下预期目的:
1. 诊断、缓解或治疗 (例如:X射线机、隐形眼镜、人工膝关节植入物)2. 测量或监测身体功能 (例如:血压或血糖监测仪)3. 用于维持或支持常态健康而没有具体医学声明的产品,如塑身设备、磁性饰品,按摩仪,这些均不被视为医疗器械
常规医疗器械分类:
| 类别 | 风险 | 代表器械(仅供参考) |
| A | 低风险 | 玻璃液体温度计、助行器、听诊器 |
| B | 中低风险 | 皮下注射针头、助听器 |
| C | 中高风险 | 呼吸机、除颤器、采血袋 |
| D | 高风险 | 心脏起搏器、植入式除颤器、心脏瓣膜 |
体外诊断试剂也是由低风险到高风险分为:A/B/C/D四类。
四. 新加坡医疗器械注册流程及路径
(一)注册流程:
1. 所有医疗器械和 IVD 产品注册必须由申请人通过 MEDICS 在线提交。
2. 提交完成并支付费用后,由HSA当局审查医疗器械申请。
3. 审查文件后,HSA当局将通过 MEDICS 生成输入请求,以请求进一步的文件和说明。
4. 所有信息交流均通过 MEDICS 系统进行,该系统会自动向申请人的电子邮件地址发送消息。
5. 在此阶段,HSA 将再次评估提交的内容,如果成功,将发出批准通知。
6. 尽管 A 类医疗器械无需进行产品注册,但在投放新加坡市场之前,必须符合法规中规定的《医疗器械安全和性能基本原则》,所有 A 类医疗器械都必须通过 MEDICS 提交豁免清单。
7. 如果医疗器械获得了美国FDA、欧洲EU NB、澳大利亚TGA、日本MHLW或加拿大HC等参考国的认证,那么拥有多个参考国认证的医疗器械在注册时将享受简化的审核流程。具体可以咨询Wiselink知汇。
(二)注册路径:
B类分为立即、全面、简化注册
C类分为立即、全面、简化、加急注册
D类分为全面、简化、加急注册
D类(含有可注册药物)分为简化和全面注册
(1)全面审核注册是指产品没有在上述五个参考国家的注册历史。
(2)简化注册是指产品至少得到一个参考国家的注册历史。
(3)C类的加急注册需要满足:至少有一个参考国家的注册历史,且产品上市3年内没有不良事件的发生,或有至少两个参考国家的注册历史;D类的加急注册:至少要有两个参考国家的注册历史。(不包含可注册药物的D类器械)
(4)B类的立即注册需要满足:至少有一个参考国家的注册历史,且产品上市3年内没有不良事件的发生,或有至少两个参考国家的注册历史;C类的立即注册只能是独立软件,且至少有一个参考国家的注册历史。
如果您对注册路径有更多疑问,可以咨询Wiselink知汇。
(三)除上述四种路径之外,还有两条全面审核路径下的优先审核计划。分别是优先审核计划1和优先审核计划2,这两种计划可以为医疗器械提供更快的注册和市场准入。
需要注意的是该计划仅适用于按照全面审核途径提交的 B、C 和 D 类器械,不包括以可注册药物为辅助作用的 D 类器械。优先审评计划的周转时间(TAT)比标准全面途径的周转时间短 25%。
申请优先审核计划1的医疗器械需要满足以下两个标准,不符合以下两个标准的医疗器械可以申请优先审核计划2。
1. 医疗器械属于五个重点医疗保健领域之一:(1)癌症(2)糖尿病(3)眼科疾病(4)心血管疾病(5)传染性疾病2. 该产品专为尚未满足的临床需求而设计和验证。这意味着:(1)它可用于诊断和治疗目前尚无其他治疗方法的疾病(2)这是一项突破性技术,比现有技术更具优势
此次知汇助力合作伙伴获得批准的C类IVD耐药五联检产品便是通过全面审核路径,由于该产品之前没有上述五个参考国家之一的注册历史,所以只能通过全面审核路径完成。如果您对全面审核路径有疑问,可以咨询Wiselink知汇以获取详细的信息。
五. 新加坡医疗器械注册所需文件清单
该文件清单以全面审核路径下的C类医疗器械注册所需文件为例
1. 执行摘要
2. 基本原则清单3. 符合性声明4. 设备描述5. 设计验证和确认文件的详细信息:临床前研究的完整报告,例如物理测试数据、生物相容性研究、动物研究和软件验证和确认研究6. 计量要求7. 灭菌验证(如适用)8. 保质期研究和预计使用寿命9. 临床评估报告,包括所引用研究的出版物和完整报告10. 设备标签11. 风险分析12. 生产和灭菌地点的名称和地址13. 质量管理体系证书,如ISO1348514. 制造工艺-流程图
如有疑问可以咨询Wiselink知汇。
六. 新加坡医疗器械注册所需费用及时间
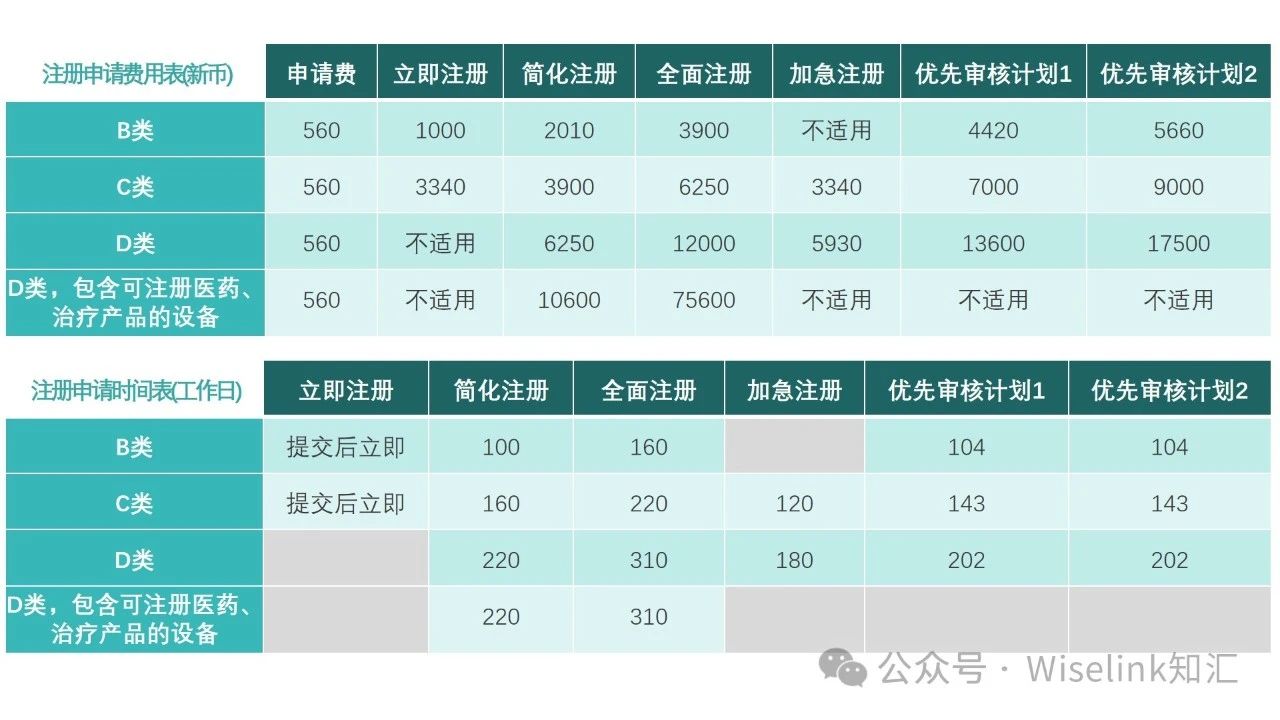
知汇Wiselink CN拥有包括原澳大利亚药品监督管理局局长Dr. Derrick Beech为首席顾问的国际专ye团队,秉承源于澳洲、扎根中国、服务世界的精神,信守专ye、真诚、开放的核心价值观,致力于为医疗器械、化妆品、食品、保健品和中药制造商提供全球合规认证和临床试验服务。
知汇Wiselink致力于为体外诊断试剂(IVD)、医疗器械(MD)、保健品和化妆品制造商提供海外临床试验和全球合规认证服务。


