滴定是一种通用性的定量测试手段,既可以对主量的元素离子进行定量,也能对痕量的物质进行测定。滴定主要包括几大因素,包括滴定用的标准溶液、指示剂、体系环境(酸碱度,盐浓度,滴定干扰等)以及处于可参与滴定反应状态的目标物。
滴定基本原理是通过已知浓度的标准溶液,与样品中的目标元素离子反应,由指示剂或电位突跃指示终点,根据消耗滴定剂的体积,计算目标物含量,由于滴定剂的消耗量与目标物的量根据反应方程式存在定量关系,因此滴定法也称为容量法。
滴定根据对终点判断的手段可以分为指示剂滴定和电位滴定,前者根据实验人员对指示剂颜色变化来判断终点,后者是根据反应完成时体系出现的电位突跃指示终点。而根据原理来区分,可以分为酸碱滴定、络合滴定、氧化还原滴定和沉淀滴定。
酸碱滴定
酸碱滴定是滴定中应用较广泛的定量方法,适用于酸、碱及两性盐类(如碳酸钠、碳酸氢钠、乙酸钠等)的定量,以及水质、油品等样品的酸值和碱度的测试。
依照布朗斯台德酸碱理论[1],凡是能给出质子的分子或离子就是酸;而能够结合质子的分子或离子就是碱。
1、酸和碱的强度分别用酸解离平衡常数(Ka)和碱解离平衡常数(Kb)表示:
Ka=[A-][H+]/[HA]
Kb=[OH-][B+]/[BOH]
2、以强酸为例,盐酸在水中完全电离,所以Ka(HCl)>1;
3、而部分弱酸如乙酸,其Ka(HCl)=1.8*10-5,在水中为部分电离。

氢氧化钠滴定盐酸曲线
酸碱滴定实验可以用滴定曲线表示。当我们以氢氧化钠滴定盐酸时,体系初始的pH值较低,随着加入的碱越来越多并接近与盐酸的量1:1时,pH值在极小的体积区间(±0.02mL)内出现急剧增大,达到平衡后趋于平缓,而pH出现突跃时滴定剂的量则为反应的终点。
而由于大部分酸碱反应都是无色的,我们需要借助相应的手段来指示酸碱反应的终点,这个时候我们就会用到酸碱指示剂,酸碱指示剂多数是有机的弱酸或者弱碱,由于其自身也会参与到质子的传递,从而发生结构上的变化并从其颜色上体现出来,因此指示剂在酸性或碱性环境下会呈现不同颜色,即酸式色和碱式色。
![]()
酸式色和碱式色的转化
以酚酞为例,它在体系中pH大于8.2的时候呈红色,当pH小于8.2的时候呈无色。然而并不是所有的酸碱指示剂都有颜色分明的酸碱指示色,比如甲基橙从酸到碱是红色变为黄色,对于终点的判断容易产生来自实验员的主观判断差异。因此,必要时我们也可以借助电位计来指示反应的终点。
络合滴定
络合滴定广泛应用于样品中常量及微量的金属离子及元素的滴定,如水中的硬度(钙镁)、聚合氯化铝的含量及锌铜镍等元素含量的测定。
络合滴定反应涉及到两个重要概念,分别是中心离子和配位体,中心离子是原子核外围有空余轨道并可容纳电子的离子(金属离子),而配位体则是其能提供孤对电子的物质。
众所周知,氯化银在水中以沉淀形式存在,而在氨水中则可以溶解。这是因为虽然氯化银本身难溶,但是其存在沉淀平衡能电离出微量的银离子,银离子由于失去一个电子其外围为空轨道,而氨(NH3)中的氮原子外围存在五个电子,其中三个电子与氢原子以共价键(N-H)的形式结合,剩下两个电子以孤对电子的形式存在。因此,Ag+和NH3能以配位键的形式结合形成银氨络离子,使氯化银溶于氨水。
![]()
氯化银与氨水的反应平衡
在络合反应中,涉及到较多的络合剂属于氨羧络合剂,是指同时存在氨基和羧基的物质,其中较常见的为乙二胺四乙酸(EDTA)及其盐类,EDTA可以与绝大多数的金属离子以1:1形成稳定的络合物。而在实际的络合滴定中,由于EDTA的二钠盐在水中的溶解性较好,所以EDTA二钠也就成为了络合滴定反应中较常用的络合剂。
然而,在滴定体系中,除了我们预期的目标离子与EDTA络合的主反应外,还会存在其他影响测试结果的副反应。由于EDTA属于有机弱酸,其在溶液状态下存在六级解离,体系中的酸碱度会影响EDTA参与解离(副反应)的程度,因此,我们需要控制体系中的pH,以减少副反应对滴定的影响。
此外,由于EDTA与多数金属离子都能络合,我们还需要考虑体系中杂质离子消耗EDTA而造成的干扰,所以我们可以使用掩蔽剂,避免受到杂质离子的影响。
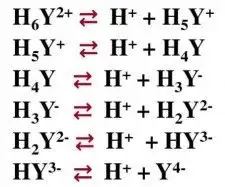
EDTA在溶液中存在六级解离平衡

EDTA滴定钙的方法简述
在实际的络合滴定中,通过使用缓冲溶液或酸碱调整体系pH,针对样品中存在的金属离子,加入相应的掩蔽剂屏蔽杂质离子的干扰,使用已知浓度的EDTA二钠标准溶液,以络合指示剂(铬黑T、钙试剂、二甲酚橙等)的颜色变化指示终点,根据标准溶液的消耗体积来计算目标离子的含量。
氧化还原滴定
氧化还原滴定的应用面非常广,理论上样品自身具有相对的氧化还原性,并具备使用氧化还原反应定量的条件,无机和有机体系均有应用。常见的如碘量法(食品中的过氧化值,消毒剂中的有效氯,金属离子铁铜锡等)、水质中的COD、肥料中的有机质、颜料中的二氧化钛等。
氧化还原滴定的基础是氧化剂和还原剂发生化学价变化的反应,化学价降低的一方为氧化剂,化学价升高的为还原剂,根据所发生氧化还原反应的定量关系,计算目标物(反应物的其中一方,氧化剂或还原剂)的含量。

使用碘量法测定有效氯的基本原理
常见的氧化剂主要是高价态的化合物,如高锰酸钾、zhonggesuanjia、氯酸盐及次氯酸盐等强氧化剂,而常见的还原剂主要是低价态的化合物,如硫代硫酸钠、草酸钠、硫酸亚铁、硫酸亚铁铵等。值得注意的是,反应物的氧化性和还原性只是在特定反应下所呈现的特点,具有相对性。
氧化还原反应的终点判断有多种方式,有的反应物本身可以同时作为指示剂,如碘量法可以通过碘单质与淀粉产生深蓝色,高锰酸钾与草酸钠反应可以通过紫色消除来判断。此外也可以使用二苯胺磺酸钠、亚甲基蓝等专用指示剂。
沉淀滴定
在化学领域中,我们都知道氯化银以沉淀的形式存在,然而生成氯化银的反应并不是单向的。氯化银实际上是一种难溶电解质,在溶液中存在着沉淀平衡。沉淀平衡可以用溶度积Ksp表征,溶度积数值的大小反映了难溶电解质的溶解能力。
如氯化银的溶度积Ksp(AgCl)=[Ag+]*[Cl-],当体系中银离子浓度乘以氯离子浓度大于Ksp(AgCl)时,沉淀平衡向沉淀产生一侧进行,体系产生氯化银沉淀。
假设一个体系中存在氯离子,我们加入xiaosuanyin,体系会生成氯化银沉淀而呈现白色浑浊,xiaosuanyin继续添加,沉淀会继续产生,现象为白色浑浊的加深,但是由于不存在明显反应终点的现象,我们不能以此通过xiaosuanyin的消耗量计算氯离子的含量。
对于同种离子组成的不同的沉淀,他们之间存在着沉淀转化的现象,即形成沉淀的物质存在一种向更低Ksp沉淀转化的趋势。
如氯化银可以转化为Ksp更低的铬酸银沉淀:
![]()
氯化银向铬酸银转化的反应方程式
利用沉淀转化的原理,以xiaosuanyin作为滴定剂,以铬酸钾为指示剂,体系中先形成氯化银沉淀,随着银离子浓度的增加,氯化银沉淀(白色)转化为铬酸银沉淀(砖红色),以体系出现砖红色为反应终点,我们可以通过计算得到氯离子的含量。
另外,我们也需要关注体系中的pH,如用铬酸钾作指示剂滴定银离子时,需要保证体系pH为6.5-10之间,过酸铬酸根会出现歧化转化成重铬酸根,过碱银离子则会形成氢氧化银。在实际的应中,沉淀滴定主要用于测定如氯、溴、碘等离子的定量。
四种滴定方法,各有其适用和不足的地方。如酸碱滴定适用于大部分呈现酸碱性的目标物,但是如果体系中存在多种酸性或碱性的物质则没办法区分,另外,对于有机弱酸等不完全电离的物质,酸碱滴定也并不适合。
对于络合滴定,其能对多种金属离子进行定量,在实际滴定过程中我们控制了酸碱度和屏蔽了干扰离子,这种方法对目标物的指向性是很高的,定量结果也更加可靠,尤其适用于混合体系中的金属离子测定。
氧化还原滴定与酸碱滴定有点类似,是根据目标物和滴定剂相对的氧化还原性来反应的,对目标物的指向性不高,体系复杂的时候可能并不适合,但是由于氧化还原反应普遍存在,使得其在化学领域得到了广泛应用。
沉淀滴定针对的目标元素离子范围相对较窄,但在保证了体系化学环境的条件下,其定量具有针对性,是对主量的氯、溴、碘等元素离子定量的主要手段。