
脉搏血氧仪是一种广泛应用于医疗领域的设备,用于非侵入性地测量动脉血氧饱和度(SpO2)和脉率。然而,近年来的研究表明,脉搏血氧仪的准确性可能受到多种因素的影响,尤其是皮肤色素沉着。
为此,美国食品药品监督管理局(FDA)发布了Zui新的指南草案。FDA要求在指南草案发布后的60天内对其进行评论。同时FDA将审查和考虑所有意见,然后Zui终确定本指南,以指导制造商和医疗专业人员更好地使用和评估脉搏血氧仪的性能。本文知汇将为您解读一下指南草案的核心内容。

原文链接:
https://www.fda.gov/media/184896/download
指南更新的核心目的
1.1提高设备性能确保脉搏血氧仪在不同皮肤色素沉着人群中的性能一致性。1.2
提高使用的有效性和安全性通过详细的标签说明,帮助用户了解设备的使用方法、局限性和潜在风险。1.3
支持上市前提交和审查为制造商提供明确的非临床和临床性能测试建议,以支持设备的上市前提交和审查。
新指南与旧指南的主要变化
2.1临床数据要求
新指南要求制造商收集更多的临床数据,以评估设备在不同皮肤色素沉着范围内的性能准确性。
2.2参与者数量增加
临床研究的参与者数量从10人增加到至少150人,以确保样本的多样性和代表性。
2.3肤色评估方法
引入了主观的Monk Skin Tone Scale和客观的calculation of individual typology angle来评估研究参与者的肤色。
2.4标签声明
如果设备在新的上市前提交中证明了性能的准确性,需增加显著的标签声明,以帮助用户识别脉搏血氧仪在不同肤色人群中的性能。
新指南的适用范围
3.1适用设备
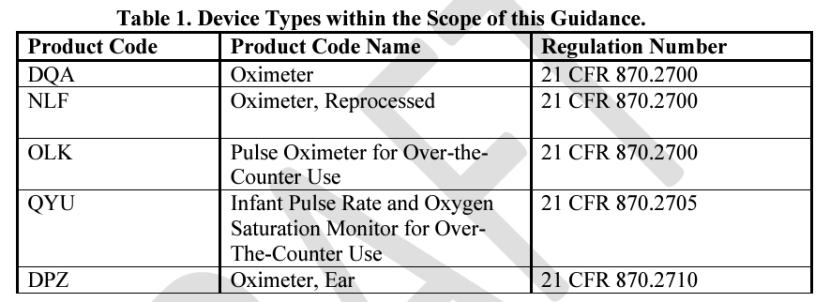
适用于某些医用脉搏血氧仪,主要用于医院或医生办公室。包括产品代码为DQA、NLF、OLK、QYU和DPZ的血氧仪。(如下图所示)
不适用设备
不适用产品代码为 OCH或PGJ的血氧仪。此外,本指南也不涉及产品代码为 MUD、NMD、QEM或 MMA的血氧仪。

新指南关于临床研究的主要变化
4.1数量显著增加
受试者数量要求显著增加,至少需要150名参与者,且每个受试者至少提供20对血氧数据,总共至少3000对数据。
标准更加严格
对受试者的招募标准更加严格,除了遵循ISO 80601-2-61标准中的入排标准外,还要求通过Monk Skin Tone Scale和比色法对受试者的肤色进行评估,并按MST水平进行分组。
参与人数变化
研究要求在不同MST分组和不同血氧饱和度水平(70%至)的每个范围内至少有30%的参与者。
人口统计信息更加详细
对人口统计信息的要求也更为详细,需要包括年龄、性别、BMI和民族等信息。这些变化旨在提高临床研究的代表性和准确性,确保脉搏血氧仪在不同肤色人群中的性能评估更为可靠。(具体要求如下图所示)


