热烈庆祝!
Wiselink英国子公司Wiselink UK正式宣布成立
这不仅标志着Wiselink在全球合规认证领域树立了新的里程碑,更意味着着英国成为Wiselink Group国际版图中第12个关键站点,紧随澳洲、爱尔兰、美国、泰国、越南、日本、新加坡、中国、中国香港、新西兰及俄罗斯之后,进一步彰显了Wiselink全球服务网络布局的深度与广度。
作为一家总部位于澳洲,致力于为医疗器械、化妆品、食品、保健品及中药制造商提供全球合规认证与临床试验服务的企业,Wiselink在全球范围内设立子公司,旨在为全球制造商提供更加便捷、高效的合规认证方案,确保产品顺利出口,合规进入国际市场。本篇文章,知汇将为您带来英国医疗器械注册的相关知识分享!
01监管当局
1.1MHRA
英国药品和健康产品管理局(Medicines & Healthcare products Regulatory Agency, 简称MHRA)负责对进入英国市场的医疗器械进行监管。针对医疗器械,MHRA具体监管如下:
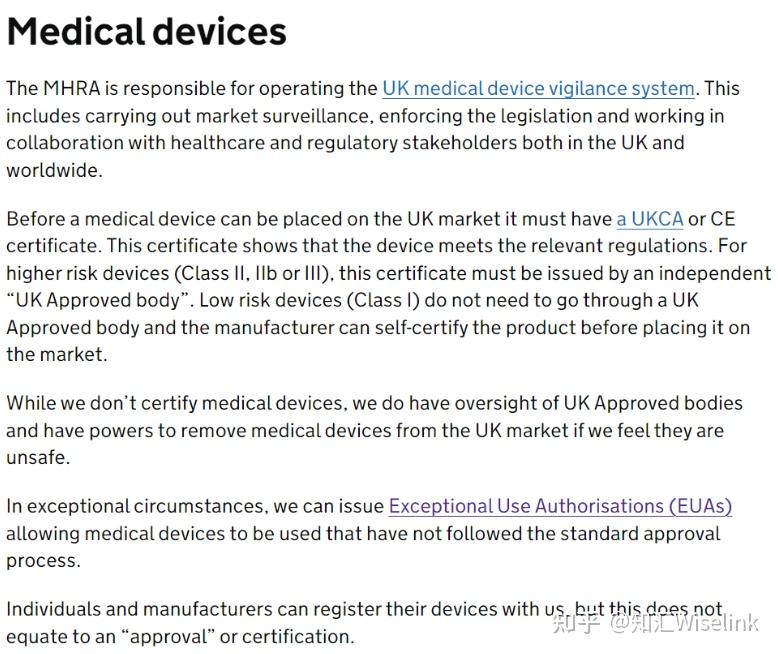
MHRA 负责运营英国医疗器械警戒系统。这包括开展市场监督、执行法规以及英国与全球的医疗保健和监管利益相关者合作。
1.2 UKCA(UK Conformity Assessment)
UKCA是英国合格评定的简称,是英国产品标志,用于在英国市场(英格兰、威尔士和苏格兰)销售的某些商品(包括医疗器械)。
2019年2月2日,英国政府公布了在无协议脱欧的情况下将会采用的UKCA标识方案。英国退出欧盟之后,欧盟的法律和监管将不再适用于英国。
英国的医疗器械市场划分为两个主要地区:大不列颠地区(涵盖英格兰、威尔士和苏格兰)以及北爱尔兰地区,这两个地区在法规上有着各自的特定要求。UKCA标志是一种新的英国产品标志,将在过渡期后用于医疗器械,在大不列颠市场上投放。UKCA 标志在欧盟、欧洲经济区或北爱尔兰市场不被认可 ,因此相关产品需要 CE 标志才能在这些市场上销售。
医疗器械在进入英国市场之前,必须获得 UKCA 或 CE 证书。该证书表明器械符合相关法规。对于高风险器械(II 类、IIb 类或 III 类),该证书必须由独立的 “英国认可机构 ”颁发。低风险设备(I 类)不需要通过英国批准机构,制造商可以在产品投放市场前进行自我认证。
02法规框架
医疗器械的UKCA标志要求基于原欧洲医疗器械指令相关的3个指令(EU AIMDD、EU MDD、EU IVDD)要求,并结合英国的医疗器械法规UK MDR 2002进行了修订,使其适用于英国。现有的英国医疗器械法规全称为The Medical Devices Regulations 2002(简称UK MDR 2002)。
2.1 基础法规
《Medical Devices Regulations 2002 (SI 2002 No 618, as amended) (UK MDR 2002)》
在过渡期(英国脱离欧盟后)结束前,以下法规使下列指令在英国法律中生效:
1. 有源植入式医疗器械指令 Directive 90/385/EEC on active implantable medical devices (EU AIMDD)2. 医疗器械指令 Directive 93/42/EEC on medical devices (EU MDD)3. 体外诊断医疗器械指令 Directive 98/79/EC on in vitro diagnostic medical devices (EU IVDD)
03确定产品分类
英国采用了与欧盟一致的风险基础医疗器械分类制度,把器械划分为四个等级:I、IIa、IIb及III,此分类体系体现了器械的风险程度,由低到高排列。
04注册产品
4.1 注册产品
在英国市场销售,需要注册的产品包括:
1. 体外诊断器械2. 定制器械
3. 系统和程序包
4. 落实变更通知义务,以下任何变更应及时通知MHRA:
a. 注册地址
b. 公司名称
c. 公司类型
d. 设备列表(例如设备变更或设备增加)
e. 体外诊断医疗设备的状态
f. 授权代表更换同时,变更上述申请必须遵守规定。
05确定上市路径
如果是在大不列颠(英格兰、威尔士和苏格兰)市场上销售医疗器械的制造商或英国责任人,首先应参考以下内容,以确认产品符合医疗器械的定义:
lRegulation 2 of the Medical Devices Regulations 2002 as they apply in Great Britain (SI 2002 No 618, as amended) (UK MDR 2002)
ldevice classification rules (Part II of the UK MDR 2002, Annex IX [as modified by Part II of Schedule 2A to the UK MDR 2002])
lguidance document MEDDEV 2.4/1 rev 9 – Classification of medical devices
lMHRA guidance on Borderlines with medical devices
lMHRA guidance on Medical device stand-alone software including apps
2021 年 1 月 1 日之前由英国公告机构颁发的 CE 证书将继续适用于英国市场。如果有变更或更新,相关英国认可机构将需要颁发新的 UKCA 证书来替换 CE 证书。同时,持有有效符合性声明和CE标志的产品,根据其符合的欧盟指令或条例,可在特定日期前在英国市场投放,具体日期如下:
符合MDD的器械:符合欧盟医疗器械指令(EU MDD)或欧盟有源植入式医疗器械指令(AIMDD)的一般医疗器械,证书Zui晚到期前或2028年6月30日前;
符合IVDD的体外诊断医疗器械:符合欧盟体外诊断医疗器械指令(IVDD)的体外诊断医疗器械(IVDs)可在英国市场上销售,证书Zui晚到期前或2030年6月30日;
Zui晚在2030年6月30日前,符合欧盟医疗器械法规(EU MDR)的普通医疗器械(包括定制器械)和符合欧盟体外诊断医疗器械法规(EU IVDR)的 IVD 可以在英国市场上销售。
以上仅针对大不列颠市场(包括:英格兰、苏格兰和威尔士)。
06注册流程
6.1 判断器械分类
根据MHRA采用的分类规则,首先需要确定您的医疗器械属于哪一类。医疗器械的分类通常基于其风险等级,从低风险到高风险不等。分类规则可能涉及器械的预期用途、与人体接触的性质、是否包含药物或生物物质等因素。
6.2 确定符合性评估路径并实施QMS
根据器械的分类,确定合适的符合性评估路径。这可能包括自我声明、第三方认证或通知机构审查等。
实施一个符合要求的体量管理体系(QMS),如EN ISO 13485标准。QMS是确保医疗器械设计、生产、销售和后续服务符合法规要求的关键。
6.3准备技术文件或设计文档
根据器械分类,准备相应的技术文件或设计文档。这些文件应详细描述器械的设计、制造、性能、安全性和有效性。对于需要英国批准机构(UKAB)认证的器械类别,需要找UKAB并递交技术文件或设计档案以供审查。审查通过后,UKAB将签发UKCA标志证书。
6.4 任命英国负责人(UKRP)和进口商
任命一个英国负责人(UKRP),负责在英国市场上器械的合规性和安全性。如果UKRP不担任进口商,则还需要任命一个英国进口商,负责将器械从其他国家进口到英国。
6.5 准备符合性声明并附上UKCA标志
准备符合性声明,声明器械符合相关法规和标准的要求。在符合性声明上附上UKCA标志,表明器械已满足英国市场的合规要求。
6.6 在MHRA器械在线注册系统(DORS)中注册器械
UKRP需要在MHRA的器械在线注册系统(DORS)中注册器械,并支付相应的申请费用。MHRA将审查申请,并可能要求提供补充信息以确保器械的合规性。
6.7 获得注册确认函
一旦申请获得批准,MHRA将为器械签发注册确认函。这是器械在英国市场上合法销售的必要文件。
07针对已获得欧盟CE认证器械的过渡政策
7.1 医疗器械产品

《Medical Devices Regulations 2002 (SI 2002 No 618, as amended) (UK MDR 2002)》
7.2 IVD体外诊断产品

这些措施并不影响在英国市场上销售带有 UKCA 标记的医疗器械的要求。MHRA 对此类器械过渡安排的预期立场可参考:Chapter 15 of the response to the consultation on future regulation of medical devices in the UK.
08注册时间
低风险的产品申请Class I & General IVDs,平均审核时间是2-4周,Zui长审理周期可以去到90天。需要Approval Body审核的产品,需要根据具体的不同AB的审核时间来确定。
09注册费用
以下是官网上宣称的费用。来源:MHRA
https://www.gov.uk/government/publications/mhra-fees/current-mhra-fees)
Wiselink拥有包括原澳大利亚药品监督管理局局长Dr. Derrick Beech为首席顾问的国际专业团队,秉承源于澳洲、扎根中国、服务世界的精神,信守专业、真诚、开放的核心价值观,致力于为医疗器械、化妆品、食品、保健品和中药制造商提供全球合规认证和临床试验服务。

